“Tenemos millones de dosis listas”: Moderna va por la autorización final de su vacuna

Los asesores de la FDA se reunirán el 17 de diciembre para evaluar la propuesta de Moderna, una semana después de la revisión sobre la vacuna de Pfizer.
Moderna Inc. planea solicitar la aprobación de su vacuna contra el coronavirus en Estados Unidos y Europa el lunes, después de que un nuevo análisis mostrara que la vacuna era altamente efectiva para la prevención del Covid-19, sin problemas de seguridad graves.
Según el análisis primario, que incluyó 196 casos, la vacuna tenía una efectividad del 94,1%, en consonancia con los datos preliminares publicados a principios de este mes. Los 30 casos graves observados en el estudio ocurrieron en participantes que recibieron un placebo, según un comunicado de la compañía, lo que indica un 100% de eficacia del tratamiento contra una enfermedad grave.
La compañía subió un 12% en la negociación prebursátil antes de la apertura de los mercados estadounidenses, alcanzando un récord de US$ 142,85. Se ha apreciado más de seis veces desde que comenzó el año.
Ante los nuevos resultados, la compañía de biotecnología con sede en Cambridge, Massachusetts, se encamina a tener una de las primeras vacunas de Covid-19 en ser aprobada en EE. UU. Una vacuna similar de Pfizer Inc. y BioNTech SE fue presentada a los reguladores estadounidenses a principios de este mes y se espera su revisión antes del tratamiento de Moderna.
Moderna dijo que planea solicitar el lunes una autorización de uso de emergencia para la vacuna en EE. UU. y la aprobación de comercialización condicional en Europa. Los asesores de la Administración de Alimentos y Medicamentos de Estados Unidos probablemente analizarán los datos en una reunión pública el 17 de diciembre, dijo la compañía, una semana después de que se realice una revisión similar de la vacuna de Pfizer, según lo previsto.
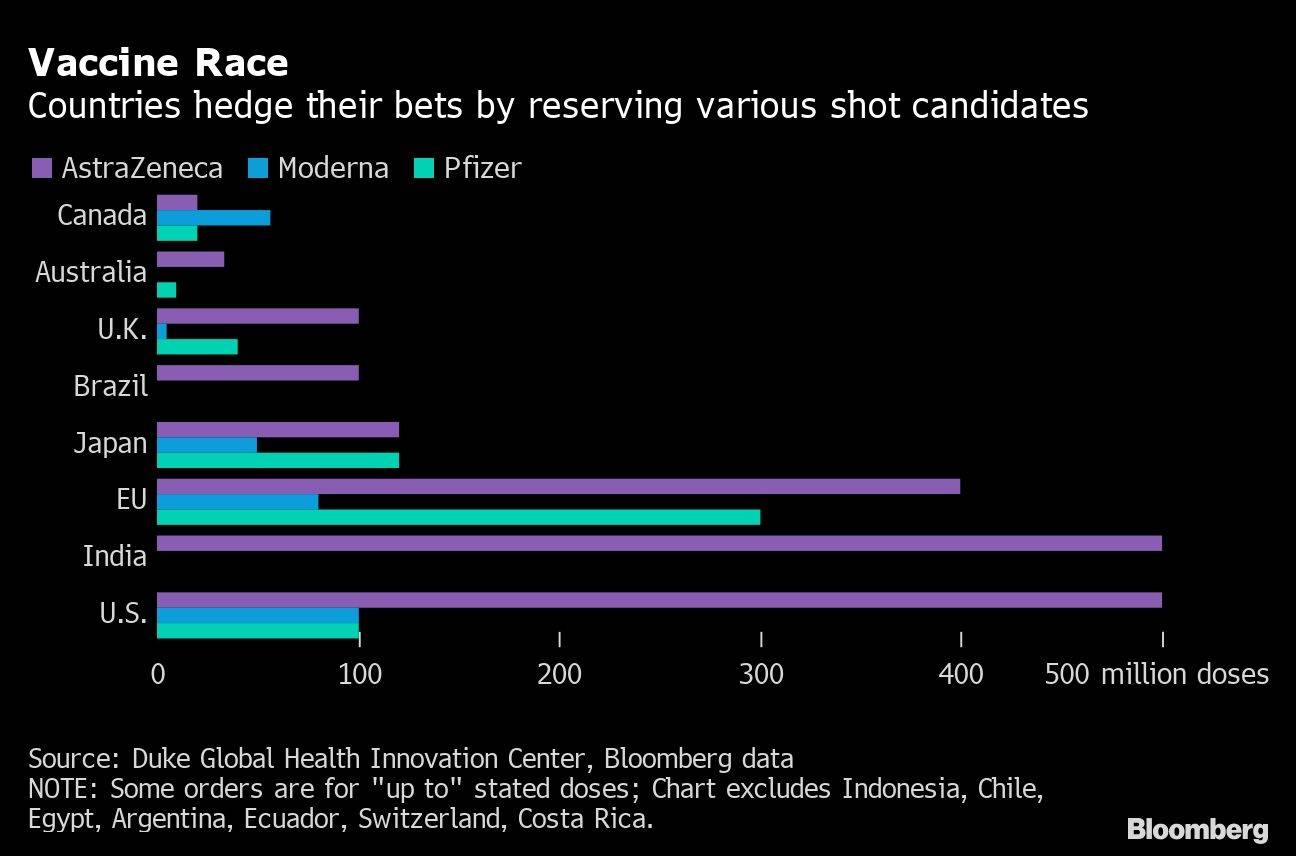
En espera del visto bueno
“Hemos estado trabajando sin descanso en las últimas semanas” para preparar los datos de la vacuna y enviarlos a los reguladores, dijo Stephane Bancel, líder ejecutivo de Moderna, en una entrevista. Una vez que las autoridades den el visto bueno, la compañía tomará medidas rápidamente para distribuir el tratamiento, parte de un vasto esfuerzo de vacunación que se desarrollará a medida que los hospitales en EE. UU. siguen bajo presión por un aumento de las infecciones.
“Estamos listos hoy para enviar la vacuna”, dijo Bancel. “Tenemos millones de dosis listas, tenemos más y más cada dos días”.
EE. UU. llegó a un acuerdo por un valor de hasta US$ 1.500 millones por 100 millones de dosis de la vacuna de Moderna en agosto. La Unión Europea, Canadá y Japón también tienen grandes acuerdos de compra, y el Reino Unido ha asegurado siete millones de dosis.
Si la vacuna se aprueba en EE. UU., lo que Bancel dijo que podría ocurrir en las 24 a 72 horas después de la reunión del 17 de diciembre, el inventario completo de Moderna se enviará al gobierno federal. Los nuevos lotes se enviarán tan pronto como se aprueben, dijo Bancel. La compañía espera poder enviar 20 millones de dosis a EE. UU. para finales de año.
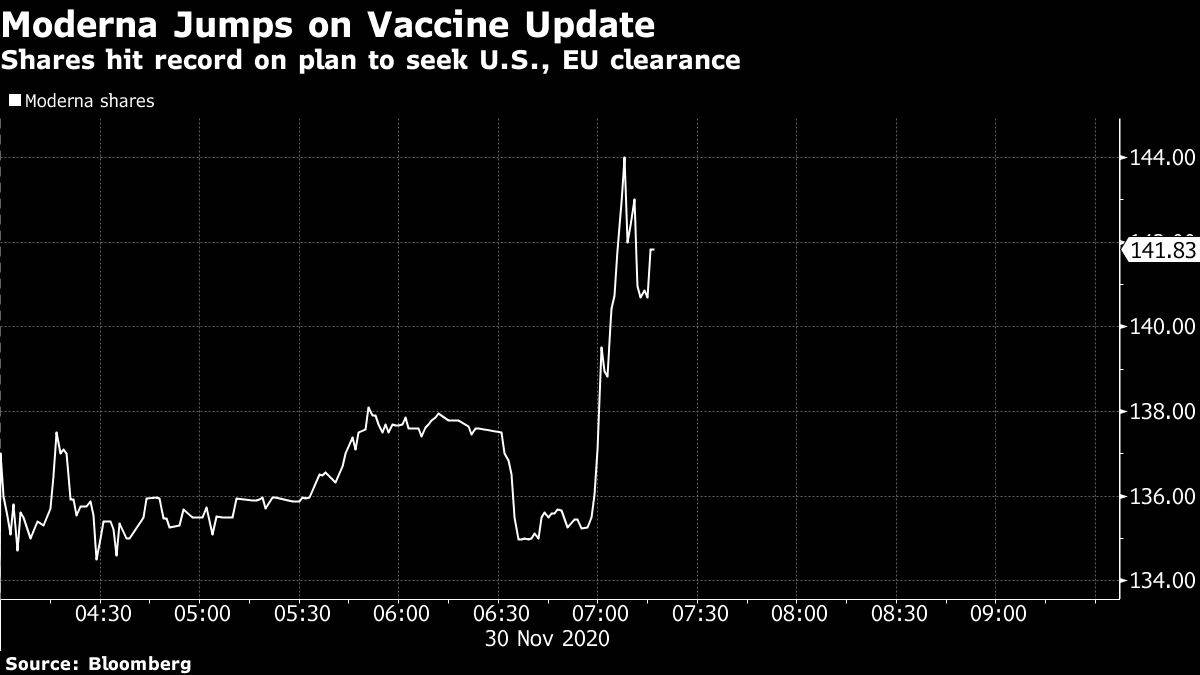
Nuevos datos
El nuevo análisis mostró que la vacuna funcionó de manera sistemática en adultos mayores y jóvenes, así como en minorías, dijo la compañía. Moderna no reveló la eficacia exacta de la vacuna en esos grupos, y Bancel dijo que aún se están trabajando en datos más detallados.
En total, hubo 185 casos de Covid-19 en participantes del ensayo que recibieron un placebo, y 11 casos en personas que recibieron la vacuna.
